肠衰竭是由于功能性或解剖结构肠段大量丢失所致,导致吸收的营养和液体不足以支持人的生存。肠衰竭主要包括:短肠综合症、肠道运动障碍、微绒毛包涵性疾病和先天性丛状肠病、肠上皮坏死或吸收细胞灾难性死亡导致的坏死性小肠结肠炎[1–3]。小肠的空肠段是营养吸收的主要肠段,自然也成为导致肠衰竭发生的主要肠段。肠衰竭病人的治疗主要依靠肠外营养甚至肠移植,但由于肠外营养的严重副作用和肠供体的短缺以及肠移植的高死亡率,肠外营养和肠移植难以成为肠衰竭的有效治疗方式[4, 5]。
对于肠上皮坏死引起的肠衰竭,促进内源性肠上皮细胞再生是治疗肠衰竭的潜在有效方式。由于哺乳动物肠上皮细胞重度损伤后动物难以存活[6],肠衰竭的哺乳动物模型难以构建。斑马鱼具有与哺乳动物相似的肠道结构和区段以及发育调控机制,其强大的再生能力是建立肠衰竭的理想模式动物[7, 8]。在肠道上皮重度损伤情况下,探索上皮细胞再生的细胞及分子机制对于开发新的肠衰竭治疗策略具有重要意义。
2023年6月20日,西南大学发育生物学与再生医学研究中心罗凌飞团队在Cell Reports上发表了题为“Extensive jejunal injury is repaired by migration and transdifferentiation of ileal enterocytes in zebrafish”的研究论文。该研究建立了斑马鱼空肠上皮细胞重度损伤后再生模型,模拟肠衰竭空肠上皮吸收细胞大量丢失和肠功能异常症状,研究发现回肠上皮细胞向前迁移至受损的空肠区域并转分化为空肠上皮细胞是空肠上皮再生的主要途径。

在该研究中,研究人员利用细菌硝基还原酶(NTR)-甲硝唑(MTZ)系统建立了斑马鱼空肠上皮细胞重度损伤模型,通过活体实时成像、Cre/loxP介导的谱系示踪、单细胞转录组等技术方法发现空肠上皮重度损伤后,回肠上皮细胞响应损伤而迁移至受损空肠区域,同时转分化为空肠上皮吸收细胞。在该过程中,细胞分裂和主动迁移驱动回肠上皮细胞向空肠迁移,IL1β-NFκB信号途径驱动回肠上皮细胞向空肠上皮细胞转分化,NFκB激动剂Ceruletide能够加速空肠上皮再生。这项研究在领域内首次发现受损肠道上皮细胞再生可通过不同肠段细胞跨肠段迁移来实现,并且回肠上皮细胞具有转化为其他肠断上皮细胞的潜能,为空肠肠衰竭的治疗提供了新的策略和潜在靶点。
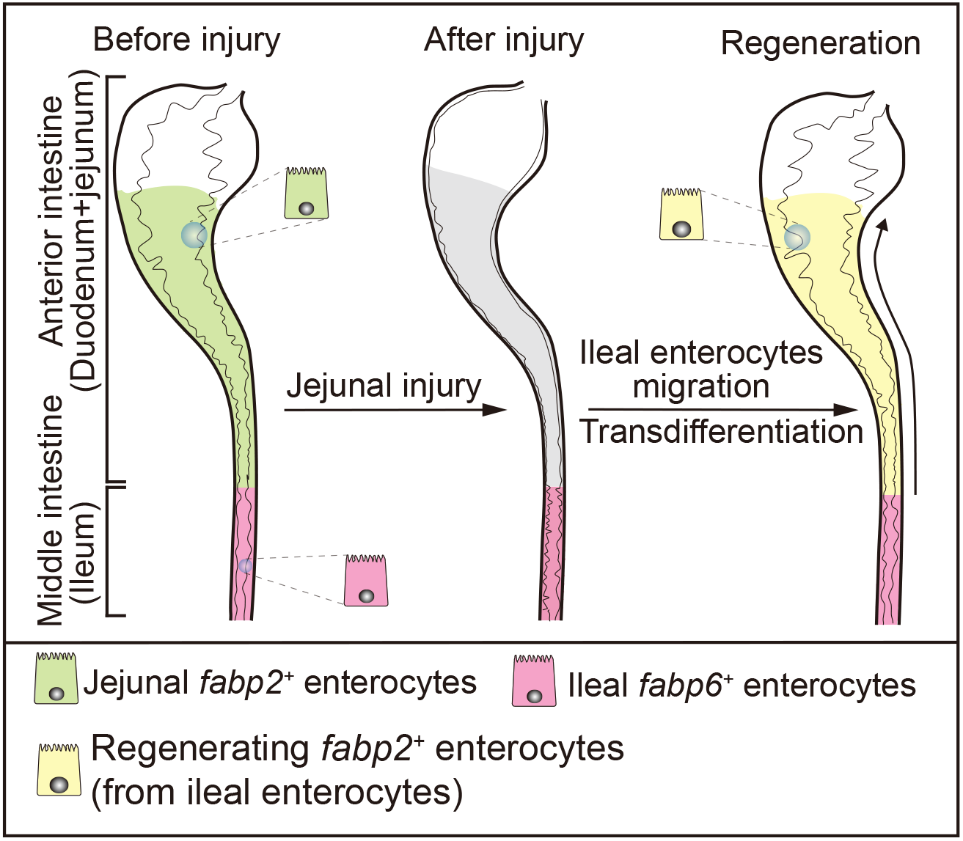
图1 斑马鱼肠道损伤-再生模式图。空肠fabp2+吸收细胞重度损伤后,回肠fabp6+吸收细胞迁移并转分化为空肠吸收细胞。
西南大学发育生物学与再生医学研究中心罗凌飞教授为本论文通讯作者,博士后魏祥勇,博士生谭新苗和陈玘为该论文的共同第一作者。
参考文献:
1. Krawinkel, M. B. et al. Chronic intestinal failure in children. Dtsch. Arztebl. Int. 109, 409–415 (2012).
2. Duggan, C. P. & Jaksic, T. Pediatric Intestinal Failure. N. Engl. J. Med. 377, 666–675 (2017).
3. Hong, S. N., Dunn, J. C. Y., Stelzner, M. & Martín, M. G. Concise Review: The Potential Use of Intestinal Stem Cells to Treat Patients with Intestinal Failure. Stem Cells Transl. Med. 6, 666–676 (2017).
4. Meran, L. et al. Engineering transplantable jejunal mucosal grafts using patient-derived organoids from children with intestinal failure. Nat. Med. 26, 1593–1601 (2020).
5. Fishbein, T. M., Gondolesi, G. E. & Kaufman, S. S. Intestinal transplantation for gut failure. Gastroenterology 124, 1615–1628 (2003).
6. Hageman, J. H. et al. Intestinal Regeneration: Regulation by the Microenvironment. Dev. Cell 54, 435–446 (2020).
7. Lickwar, C. R. et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biol. 15, e2002054 (2017).
8. Schall, K. A. et al. Adult zebrafish intestine resection: a novel model of short bowel syndrome, adaptation, and intestinal stem cell regeneration. Am. J. Physiol. Gastrointest Liver Physiol. 309, G135-45 (2015).