2022年10月17日,发育生物学与再生医学研究中心李礼/罗凌飞/赵方莹课题组合作,在Nature Communications上发表了题为“Brain milieu induces early microglial maturation through the BAX-Notch axis”的论文。该研究利用斑马鱼和小鼠等模式动物,揭示经典促凋亡因子Bax通过神经元活性调控Notch通路进而促进小胶质细胞成熟。

小胶质细胞是大脑定居型巨噬细胞,占所有脑细胞的10-15%[1]。这群细胞吞噬和清除脑中异常组分,分泌细胞因子促进脑发育和神经修复,调控神经元活性,突触修剪等[2]。小胶质细胞对于维持神经系统稳态至关重要,也在神经发育和神经系统疾病中扮演重要角色[3]。近年来,小胶质细胞作为候选靶点来治疗神经退行性疾病的前景被广泛讨论,使得如何有效获得并维持小胶质细胞特性亟待解决。因此,解析小胶质细胞的发育过程,尤其是成熟机理尤为迫切。
在发育进程中,小胶质细胞起源于胚胎期卵黄囊的血液髓系祖细胞[4]。这群细胞进入脑后进一步分化和成熟为小胶质细胞。小胶质细胞的发育与早期神经发生密切相关,提示脑微环境在促进小胶质细胞成熟并赋予其身份的过程中尤为关键。源于小鼠的研究揭示了脑微环境的TGF-β1是促进小胶质细胞分化的重要驱动因子。在体外培养过程中,补加TGF-β1可有效诱导成熟小胶质细胞特异基因的表达。但即便在含有CSF-1,TGF-β2和胆固醇的原代培养基中,小胶质细胞依然会在分离后迅速失去特性,而将该细胞移植回完整的脑后他们的特征得到有效恢复。这些研究提示小胶质细胞的成熟和特性维持需要来自脑微环境其他信号的参与,但相关机制一直不明。
该研究通过ENU正向遗传筛选获得一个小胶质细胞成熟缺陷的突变体baxcq55。研究表明bax通过神经元来调控小胶质细胞成熟。Bax是经典的线粒体信号通路促凋亡因子[5],但在baxcq55突变体中诱导神经元凋亡或外源提供凋亡信使ATP,却不能够诱导小胶质细胞成熟,尽管baxcq55突变体小胶质前体细胞在此状态下显著增多。因此Bax的经典促凋亡功能可以有效吸引小胶质前体细胞定植却不足以实现其成熟。
本研究揭示Bax通过钙信号途径启动CaMKII-CREB通路,促使神经元表达并在胞体膜上富集Notch配体Dlb,进而激活与神经元密切接触的小胶质前体细胞中的Notch信号。随后,研究者进一步证实Notch信号激活对小胶质细胞的成熟至关重要。该机制在小鼠中保守,且在体外细胞培养体系中可显著提高并维持小胶质细胞特性。该研究解析了脑微环境赋予小胶质细胞特性的保守机制,有助于理解神经系统对于小胶质细胞发育和功能的影响,进而为实现有效诱导小胶质细胞成熟并将其作为潜在靶点来缓解和治疗神经退行性疾病提供参考。
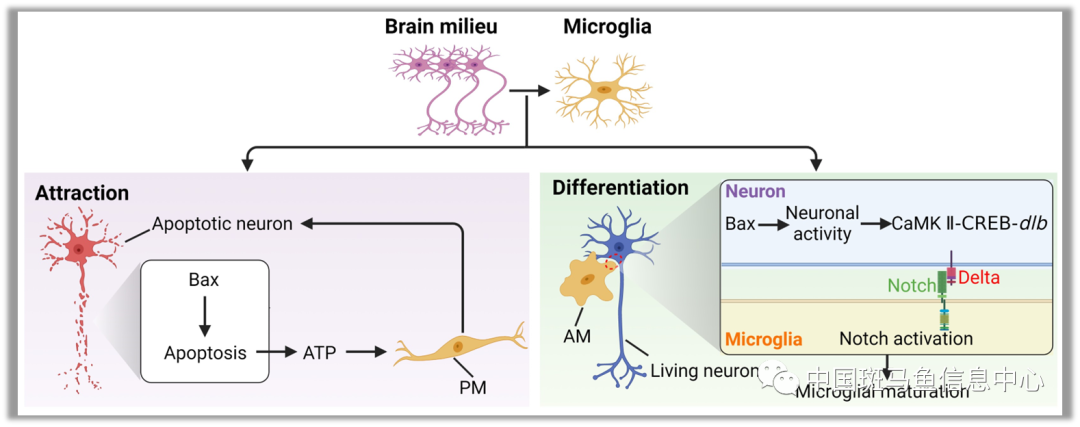
本研究的工作模式图
发育生物学与再生医学研究中心赵方莹博士、博士生贺蒋勇为论文共同第一作者。李礼研究员和罗凌飞教授为共同通讯作者。同时,该研究得到了重庆邮电大学赵从健教授、发育生物学与再生医学研究中心马鸣教授及第四军医大学王亚洲教授的指导和帮助。
参考文献:
1.Nayak D, Roth TL, McGavern DB. Microglia development and function. Annu Rev Immunol 32, 367-402 (2014).
2. Li Y, Du XF, Liu CS, Wen ZL, Du JL. Reciprocal regulation between resting microglial dynamics and neuronal activity in vivo. Dev Cell 23, 1189-1202 (2012).
3. Perry VH, Nicoll JA, Holmes C. Microglia in neurodegenerative disease. Nat Rev Neurol 6, 193-201 (2010).
4. Ginhoux F, Prinz M. Origin of microglia: current concepts and past controversies. Cold Spring Harb Perspect Biol 7, a020537 (2015).5. Yuan J, Yankner BA. Apoptosis in the nervous system. Nature 407, 802-809 (2000).