肝脏是人体最大的消化器官,具有储存糖原、解毒、胆汁分泌、脂质代谢及转运、尿素代谢及分泌血浆蛋白等重要生理功能。同时肝脏极易受到损伤,肝脏在轻度受损后新生肝细胞主要来源于残留肝细胞的自我增殖;肝脏在重度受损后(如晚期肝硬化和肝癌),残留的肝细胞因高度纤维化而失去了自我增殖能力,此时唯一的治疗手段就是切除病变组织并移植入健康的肝脏,但因供体不足、免疫排斥等因素致使晚期肝病的死亡率长期居高不下。因此,研究肝脏重度受损后前体细胞增殖分化的调控机制具有重要的意义。西南大学罗凌飞课题组数年前利用斑马鱼肝脏重度受损再生模型率先发现在肝脏极度损伤情况下,新生肝脏细胞来源于成熟胆管细胞的转分化(He et al., 2014),揭示了mTORC1(mammalian target of rapamycin complex 1)信号途径调控肝脏再生起始——即胆管细胞去分化过程(He et al., 2019);进一步发现FXR信号能够调控双潜能前体细胞转变为新生肝细胞和胆管细胞的再分化过程(Cai et al., 2021)。但到目前为止,对于肝脏重度受损后增殖分化的重要调控因子及其机制所知甚少。
2022年4月5日,西南大学罗凌飞课题组和何建波课题组利用斑马鱼肝脏重度受损模型,进一步揭示了Tel2调控双潜能前体细胞的再分化和增殖影响斑马鱼肝脏再生的作用机制。该研究以“Tel2 regulates redifferentiation of bipotential progenitor cells via Hhex during zebrafish liver regeneration”为题在线发表于Cell Reports。

在此项研究中,研究人员利用斑马鱼ENU正向遗传突变筛选,鉴定出一个具有特异性肝脏再生缺陷的突变体,命名为liver logan (lvl)。lvl肝脏的早期发育与野生型相比并无差别,但肝脏极度受损后胆管细胞驱动的肝脏再生会出现严重缺陷。通过基因定位克隆、CRISPR/Cas9敲除和野生型Tel2过表达,研究人员确定了该突变体的表型为tel2基因突变所导致。
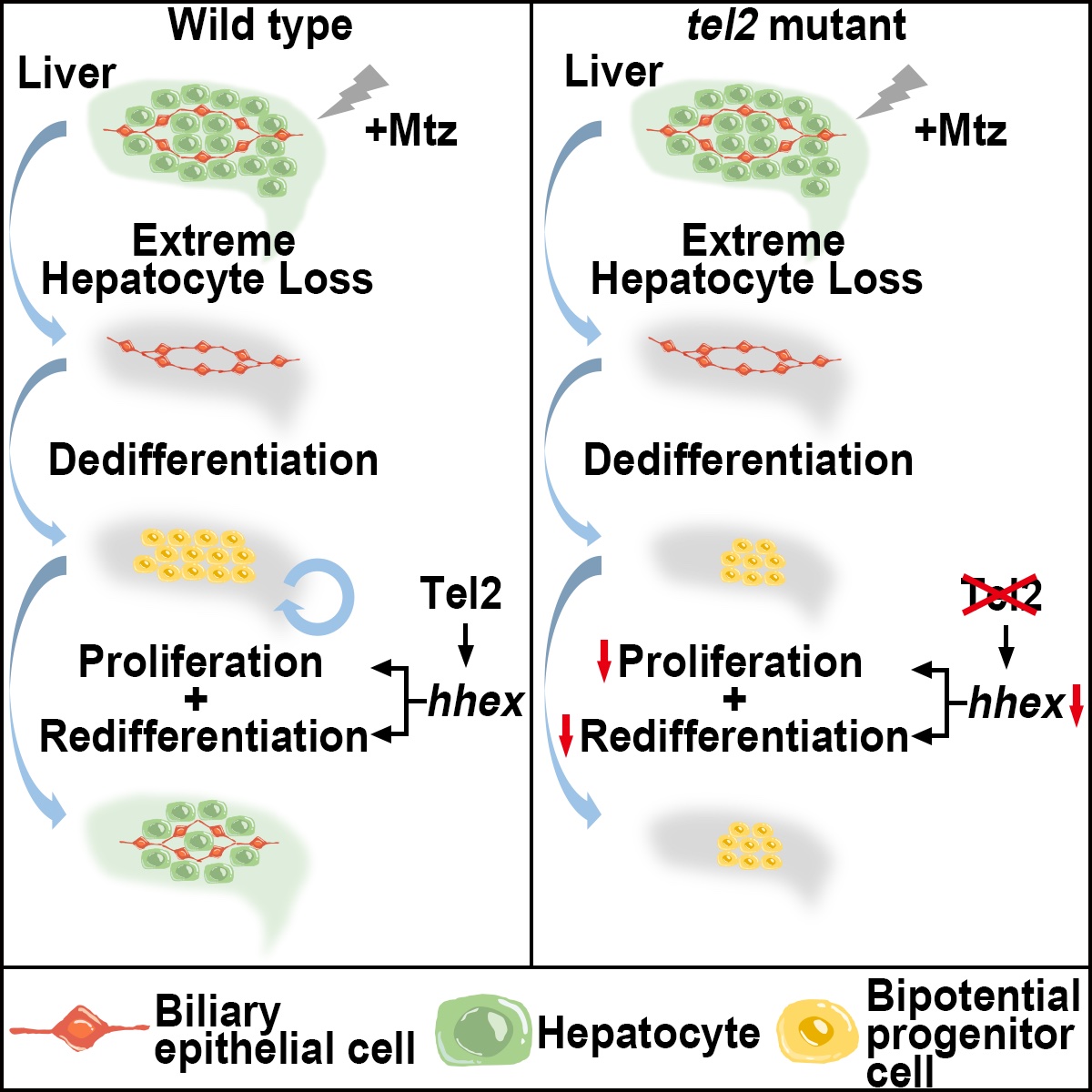
为揭示Tel2调控斑马鱼肝脏再生的作用机制,研究人员发现lvl突变体中胆管细胞能够正常去分化为双潜能前体细胞,但双潜能前体细胞的再分化和增殖过程被抑制。此外,肝母细胞标记基因hhex在肝脏再生中的再激活也被阻断。而通过CRISPR/Cas9构建的hhex突变体具有与lvl相似的肝脏再生缺陷表型,并且过表达Hhex能够部分回救lvl突变体肝脏再生中双潜能前体细胞的再分化和增殖。进一步的机理研究表明,Tel2能够与hhex基因的启动子区域结合并促进hhex的转录。该研究证实了斑马鱼肝脏重度损伤后,Tel2-Hhex参与调控双潜能前体细胞再分化和增殖的重要机制,为晚期肝病患者的治疗提供了潜在的药物靶点。
该发现对于深入理解晚期肝病患者促进肝脏原位再生具有潜在的临床意义。该研究以西南大学发育生物学与再生医学研究中心罗凌飞教授和何建波教授为共同通讯作者,张君仁博士和周洋博士为论文的共同第一作者。
参考文献:
He, J., Chen, J., Wei, X., Leng, H., Mu, H., Cai, P., and Luo, L. (2019). Mammalian Target of Rapamycin Complex 1 Signaling Is Required for the Dedifferentiation From Biliary Cell to Bipotential Progenitor Cell in Zebrafish Liver Regeneration. Hepatology 70, 2092-2106.
He, J., Lu, H., Zou, Q., and Luo, L. (2014). Regeneration of liver after extreme hepatocyte loss occurs mainly via biliary transdifferentiation in zebrafish. Gastroenterology 146, 789-800 e788.
Cai, P., Mao, X., Zhao, J., Nie, L., Jiang, Y., Yang, Q., Ni, R., He, J., and Luo, L. (2021). Farnesoid X Receptor Is Required for the Redifferentiation of Bipotential Progenitor Cells During Biliary‐Mediated Zebrafish Liver Regeneration. Hepatology 74, 3345–3361.